Monitoring Efek Samping Obat Kemoterapi Pada Pasien Kanker Payudara
Oleh:
apt Adriyanto Rochmad Basuki, M.Farm
apt Gita Mayasari, M.Sc
Instalasi Farmasi RSUD Kota Yogyakarta
Jl. Wirosaban No. 1 Telp (0274) 371195, Kota Yogyakarta, Daerah Istimewa Yogyakarta, Indonesia
Pendahuluan:
Menurut data Globocan IARC (Global Cancer Observatory International Agency for Research on Cancer) pada tahun 2018 diperkirakan ada sekitar 18,1 juta diagnosis kasus baru kanker dengan 11,6% adalah kasus kanker payudara (Bray et al., 2018).. Berdasarkan data Globocan tahun 2020 jumlah penderita kanker payudara sebesar 16,6% di Indonesia. Tingkat kematian akibat kanker payudara sekitar 932 per 100.000 total kematian pada tahun 2012 (Ng.Z et al., 2017). Kanker payudara adalah pertumbuhan sel yang abnormal dan tidak terkendali pada kelenjar penghasil susu (lobular), saluran kelenjar dari lobular ke puting payudara (ductus), atau jaringan penunjang payudara (stroma) (NCCN, 2016). Hipotesa patofisiologis kankerpayudara sendiri adalah sebagian besar dimulai dari hiperproliferasi ductus dan kemudian berkembang menjadi tumor jinak atau bahkan karsinoma metastasis setelah terus-menerus distimulasi oleh berbagai faktor karsinogenik (Sun et al., 2017).
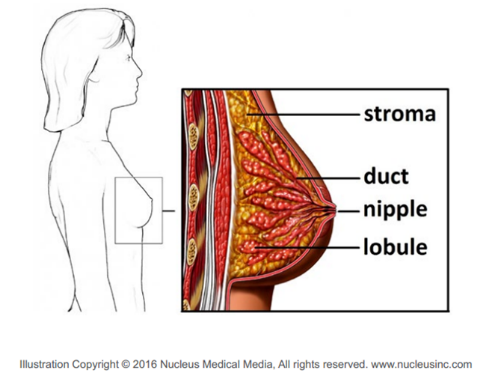
Berdasarkan kriteria fitur patologis dan invasif, kanker payudara secara umum dapat dibagi menjadi dua golongan utama : non-invasif (atau in situ), invasif dan metastasis (Feng et al., 2018). Setelah kanker payudara didiagnosis, pasien ditentukan stadium penyakit secara klinis menggunakan pedoman American Joint Commission on Cancer (AJCC) (Shah, 2014). Berdasarkan AJCC untuk penentuan stadium penyakit kanker payudara menggunakan TNM stage. Sistem TNM anatomi adalah metode untuk pengkodean luasnya penyakit. Hal ini dilakukan dengan menetapkan kategori luasnya penyakit untuk tumor (T/ tumour primer), kelenjar getah bening regional (N/ Node lymph regional clinical) dan metastasis luas atau jauh (M/ Metastasis). T, N, dan M ditentukan secara klinis dan dengan menambahkan temuan hasil pembedahan dan informasi patologis pada informasi klinis. Beberapa faktor resiko yang berhubungan dengan kanker payudara antara lain : jenis kelamin wanita, usia > 50 tahun, riwayat keluarga dan genetik, riwayat penyakit payudara sebelumnya, riwayat menstruasi dini /menarche(< 14 tahun) atau menopause lambat (>55 tahun), riwayat reproduksi (tidak memiliki anak dan tidak menyusui), hormonal, obesitas, konsumsi alkohol, riwayat radiasi pada dinding dada (Lakshmi et al, 2012; Panigoro et al., 2008), dan riwayat merokok (Laksmi et al, 2012; Angahar, 2017).
Modalitas terapi kanker payudara antara lain melalui prosedur pembedahan, terapi radiasi atau kombinasi keduanya, terapi sistemik dengan kemoterapi, terapi endokrin, terapi target. Kebutuhan dan pemilihan terapi pembedahan maupun sistemik didasarkan pada prognostic dan faktor prediktif. Faktor-faktor ini termasuk karakteristik histologi tumor, klinis dan patologis tumor primer, status kelenjar getah bening aksila, reseptor hormon tumor (reseptor estrogen / reseptor progesteron [ER / PR], status HER2, pengujian multigene (Bevers et al., 2017).
Kemoterapi :
Kemoterapi adalah pengobatan menggunakan obat sitostatika. Obat sitostatika bekerja pada sel-sel aktif. Sel aktif adalah sel yang masih tumbuh dan membelah. Sel-sel kanker termasuk sel yang aktif tumbuh seperti sel sehat (Mounika, 2016). Kemoterapi diberikan secara bertahap dalam beberapa siklus agar mendapatkan efek yang diharapkan dengan efek samping yang masih dapat ditoleransi. Hasil pemeriksaan imunohistokimia memberikan beberapa pertimbangan penentuan regimen kemoterapi yang akan diberikan (Panigoro et al., 2008). Menurut NCCN untuk prosedur kemoterapi dapat dilakukan setelah pembedahan (kemoterapi ajuvan) maupun sebelum pembedahan (kemoterapi neo ajuvan). Obat kemoterapi tunggal maupun kombinasi sering digunakan dalam pengobatan kanker payudara (NCCN, 2016).
Mekanisme kerja obat kemoterapi:
Beberapa regimen obat sitotoksik dalam terapi sistemik yang pada umumnya digunakan antara lain:
| Golongan | Contoh Obat | Mekanisme Kerja |
| Golongan alkylating agen | mustard nitrogen, cyclophosphamide | Obat-obatan ini bekerja pada DNA sel tumor dengan memutus rantai helix , mengganggu protein terkait DNA, atau memodifikasi ekspresi gen tertentu (Espinosa et al., 2003) |
| Golongan Taxanes | paclitaxel dan docetaxel | Mekanisme kerja sebagai penghambat dinamika mikrotubulus yang mempromosikan polimerisasi mikrotubulus dan menghambat depolimerisasi, yang menghasilkan penghentian siklus sel pada Fase G2 dan M dan menyebabkan kematian sel (Nabholtz & Gligorov, 2005). |
| Golongan Platinum agent | carboplatin, cisplatin, oxaliplatin | Golongan platinum merupakan kompleks logam berat organik. Ion klorida hilang dari molekul setelah berdifusi menjadi sel yang memungkinkan senyawa saling silang dengan untai DNA, sebagian besar ke gugus guanin. Hal ini menyebabkan ikatan silang DNA intra dan interstrand, menghasilkan penghambatan sintesis DNA, RNA, dan protein (Payne & Miles, 2013) |
| Golongan Antibiotik | Antrasiklin (doxorubicin, epirubicin, daunorubicin) | mempengaruhi fungsi dan sintesis asam nukleat dengan berbagai cara(Payne & Miles, 2013) |
| Golongan alkaloid vinka | Vincristin, vinblastine, vinorelbin | Mekanisme alkaloid vinka dengan mengikat tubulin, blok bangunan mikrotubulus. Hal ini menghambat perakitan spindel lebih lanjut selama metafase, sehingga menghambat mitosis (Payne & Miles, 2013) |
Efek samping obat kemoterapi:
Efek samping obat terjadi ketika obat kemoterapi ikut merusak sel sehat (Mounika, 2016). Beberapa keluhan efek samping yang sering muncul setelah penggunaan obat kemoterapi antara lain mual, muntah, alopecia, neuropati, anorexia (Shakya et al., 2017), sembelit, fatique, insomnia, disfungsi kognitif (Saini et al., 2015), anemia, demam, neutropenia dan kelemahan otot. Penelitian yang dilakukan oleh Xu et al. (2016) menunjukkan sebanyak 3.962 (89,5%) pasien mengalami anemia selama kemoterapi.
Monitoring efek samping obat kemoterapi :
Efek samping obat kemoterapi menjadi faktor risiko yang tidak dapat dihindari terkait dengan proses kemoterapi kanker. Diperlukan kehati-hatian untuk mendeteksi, penilaian, pemantauan, pelaporan dan pencegahannya (Shrestha et al., 2017). Pemantauan efek samping obat kemoterapi yang dilakukan oleh seorang farmasis di layanan Rumah Sakit salah satunya dapat menggunakan formulir CTACE (Common Terminology Criteria for Adverse Event) yang dikembangkan National Cancer Institute. Formulir ini mendeskripsikan keluhan efek samping obat yang dialami pasien dan tingkat severity yang dialami sehingga dapat digambarkan dalam beberapa level: mild, moderate, severe dan life threatening. Penilaian dapat dilakukan menggunakan beberapa parameter laboratorium hasil pemeriksaan pasien misalnya untuk status hemoglobin, leukosit, trombosit, neutrofil dan lain-lain maupun interview dengan pasien pasca kemoterapi misalnya terkait keluhan mual, muntah, pusing yang dialami baik derajat keluhan maupun frekuensi kejadian. Hasil pemantauan dapat didokumentasikan secara terstruktur dan bila perlu dapat dikonsultasikan dengan klinisi penanggung jawab apabila menyentuh nilai kritis tertentu. Formulir dapat diperbarui sesuai kondisi lapangan dan kebutuhan layanan. Contoh formulir pemantauan efek samping obat kemoterapi yang telah disesuaikan :

Berikut ini merupakan salah satu contoh hasil pemantauan efek samping obat kemoterapi yang dilakukan farmasis di Rumah Sakit “ XYZ”
| No | Efek Samping Obat Kemoterapi yang dialami | Mild n= pasien (%) | Moderate n= pasien (%) | Severe n:pasien(%) | Life Treathening n : (%) |
| 1. | Nausea | 29 ( 76.3) | 9 (23.7 ) | 0 | 0 |
| 2. | Alopecia | 33 ( 97.1) | 1 (2.9 ) | 0 | 0 |
| 3. | Anemia | 27 (81.8) | 5 (12.2) | 0 | 1(2.4) |
| 4. | Anoreksia | 22 (78.6) | 5 (17.9) | 1 (3.6) | 0 |
| 5. | Leukopenia | 4 (14.8) | 9 (33.3) | 8 (29.6) | 6 (22.2) |
| 6. | Gangguan otot | 15 (100.0) | 0 | 0 | 0 |
| 7. | Vomiting | 4 ( 30.8 ) | 8 ( 61.5 ) | 1 (7.7) | 0 |
| 8. | Gangguan tidur | 9 (90.0) | 1 (10.0) | 0 | 0 |
| 9. | Sembelit | 7 (77.8) | 1 (11.1) | 1 (11.1) | 0 |
| 10. | Trombositopenia | 8 (88.9) | 1 (11.1) | 0 | 0 |
| 11. | Diare | 6 (75.0) | 1 (12.5) | 1 (12.5) | 0 |
| 12. | Demam | 6 (100.0) | 0 | 0 | 0 |
| 13. | Stomatitis | 2 (66.7) | 1 (33.3) | 0 | 0 |
PENUTUP :
Farmasis yang mengabdikan ilmunya di rumah sakit mempunyai peranan besar dalam pemantauan efek samping obat kemoterapi sehingga dapat membantu meningkatkan keamanan penggunaan obat terutama di layanan yang beresiko tinggi. Hal ini merupakan salah satu tugas pelayanan farmasi klinis di rumah sakit yang masih harus ditingkatkan secara terus menerus demi tercapainya outcome klinis pasien yang lebih baik.
Daftar Pustaka :
Angahar, L.T. (2017). An Overview of Breast Cancer Epidemiology, Risk Factors, Pathophysiology, and Cancer Risks Reduction. MOJ Biology and Medicine, 1(4), 92–96. https://doi.org/10.15406/mojbm.2017.01.00019
Bray, F., Ferlay, J., Isabelle , S., Rebecca , L., Siegel, Lindsey , A., Torre , Ahmedin, J. (2018). Global Cancer Statistics 2018: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries, doi: 10.3322/caac.21492 cacancerjournal.com Ca Cancer J Clin 2018;68:394–424
Bevers, T. B., Anderson, B.O., Bonaccio, E., Buys, S., Daly, M. B., Dempsey, P. J.,Yankeelov, T. (2017). Breast Cancer Screening and Diagnosis. Journal of the National Comprehensive Cancer Network, 7(10), 1060–1096. https://doi.org/10.6004/jnccn.2009.0070
ECOG. (2007).Common Toxicity Criteria ECOG. 1–2. https://doi.org/10.1007/978-3-540-29805-2_809
Espinosa, E., Zamora, P., Feliu, J., & Barón, G.M., (2003). Classification of anticancer drugs – A new system based on therapeutic targets. Cancer Treatment Reviews, 29(6), 515–523. https://doi.org/10.1016/S0305-7372(03)00116-6
Feng, Y., Spezia, M., Huang, S., Yuan, C., Zeng, Z., Zhang, L., Ren, G. (2018). Breast cancer development and progression: Risk factors, cancer stem cells, signaling pathways, genomics, and molecular pathogenesis. Genes and Diseases, 5(2), 77–106. https://doi.org/10.1016/j.gendis.2018.05.001
Lakhsmi.R, Athira. R, Mary.J.T, Vijayalakhsmi.S, 2012, Breast Cancer Risk factor : Preventable and non preventable, International Journal Riset Of Pharmacy, 3:(10)
Mounika, M. (2016). Review on : Adverse Drug Reactions of Chemotherapy Drugs. 4(3), 85–93.
National Comprehensive Cancer Network, (2016). NCCN Guidelines for Patients, Breast Cancer Early Stage, Stage I-II, version 1. 2016.
Nabholtz , Jean-Marc & Gligorov, Joseph (2005). The role of taxanes in the treatment of breast cancer La PrandieBreast Cancer Research Institute, , Valojoulx, France
Nabholtz, Jean-marc, A., (2003). “Docetaxel – Anthracycline Combinations in Metastatic Breast Cancer.” 79.
National Cancer Institute, US Department of Health and Human Services (2017). Common Terminology Criteria For Adverse Event, http : //www.meddra.org , publised : nove 27, 2017
Ng, Z., Ong, M., Jegadeesan, T., Deng, S., & Yap, C. (2017). Breast Cancer: Exploring the Facts and Holistic Needs during and beyond Treatment. Healthcare, 5(2), 26. https://doi.org/10.3390/healthcare502002, Yong Loo Lin School of Medicine, National University of Singapore
Sun , Y., Zhang, Z.Z., Xu, F., Lu, H.J., Zhu, Z.Y., Shi, W., Jiang, J.,Yao, P.P., Zhu1, H.P., (2017). Review Risk Factors and Preventions of Breast Cancer, International Journal of Biological Sciences2017; 13(11): 1387-1397. doi: 10.7150/ijbs.21635
Shah, R. (2014). Pathogenesis, prevention, diagnosis and treatment of breast cancer. World Journal of Clinical Oncology, 5(3), 283. https://doi.org/10.5306/wjco.v5.i3.283
Panigoro, S., Hernowo, B.S., Purwanto, H., Handojo, D., Haryono, S.J., Arif, W., Ramadhan, Kardina, Boediardja, S.A., Reksodiputro, A.H., Gondhowiardjo, S., Soediro, R., Kodrat, H., Tjahjadi, H., Fauziah, D., Chandra, S., Kurnia, A., Dien, A.W., Purwanto, D.J., Gautama, W., Kartini, D., (2008). Panduan Penatalaksanaan Ca mammae. Kementerian Kesehatan Republik Indonesia. Komite Penanggulangan Kanker Nasional., 1, 12–14, 24–26, 45.
Payne, S., & Miles, D., (2013). Mechanisms of anticancer drugs. Scott-Brown’s Otorhinolaryngology: Head and Neck Surgery 7Ed, 34–46. https://doi.org/10.1201/b15118-6
Saini, V. K., Sewal, R. K., Ahmad, Y., & Medhi, B. (2015). Prospective Observational Study of Adverse Drug Reactions of Anticancer Drugs Used in Cancer Treatment in a Tertiary Care Hospital. Indian Journal of Pharmaceutical Sciences, 77(6), 687–693.Retrievedfrom ttp://www.ncbi.nlm.nih.gov/pubmed/26997696%0Ahttp://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=PMC477822
Shrestha, S., Shakya, R., Shrestha, S., & Shakya, S. (2017). Adverse Drug Reaction due to Cancer Chemotherapy and its Financial Burden in Different Hospitals of Nepal. International Journal of Pharmacovigilance, 2(1), 1–7. https://doi.org/10.15226/2476-2431/2/1/00114
Xu, H., Xu, L., Page, J. H., Cannavale, K., Sattayapiwat, O., Rodriguez, R., & Chao, C. (2016). Incidence of anemia in patients diagnosed with solid tumors receiving chemotherapy, 2010-2013. Clinical Epidemiology, 8, 61–71. https://doi.org/10.2147/CLEP.S89480

